<基礎研究>
1. 吸啜・咀嚼運動制御に関わる中枢神経細胞(三叉神経系ニューロン)の神経生理学的機能解析
吸啜・咀嚼運動に関わる基本的な運動パターンは、脳幹吻側に開閉口筋それぞれ独立して存在するリズム形成機序(central pattern generator: CPG)により形成されることが、遊離脳幹標本(isolated brainstem preparation technique)を用いた当教室の研究より明らかになっています(Tanaka et al., 1999, Kogo et al., 1996, 1998)。CPGを構成する三叉神経系ニューロンの機能をさらに明らかにするために、脳幹スライス標本を用いてパッチクランプ法による電気生理学的解析を三叉神経運動ニューロン、中脳路核ニューロンを対象に行い、これまでにresonance、内因性バースト活動など特異な膜特性がリズム形成機序に関わっていることを報告しています (Tanaka et al., 2003, 2006, Enomoto et al., 2006, 2007)。その後の研究成果より、三叉神経運動ニューロンには発火活動の長期増強作用が認められることや、中脳路核ニューロンのバースト活動制御に関わるNa+, K+電流の特性、生後発達や発火特性を修飾する神経伝達物質の作用についてより詳細なメカニズムが明らかとなっています。

関連論文
- Tanaka S, Tomita I, Seki S, Yamada S, Kogo M, Furusawa K. Serotonergic modulation of slow inward rectification in mesencephalic trigeminal neurons. Brain Res. 2019 Sep 1;1718:126-136. doi: 10.1016/j.brainres.2019.05.013. Epub 2019 May11.
- Enomoto A, Seki S, Tanaka S, Ishihama K, Yamanishi T, Kogo M, Hamada S. Development of resurgent and persistent sodium currents in mesencephalic trigeminal neurons.J Neurosci Res. 2018 Feb;96(2):305-312. doi: 10.1002/jnr.24134. Epub 2017 Jul 28.
- Tanaka S, Enomoto A, Yamada S, Seki S, Tsuji T, Ishihama K, Kogo M. Slow inward rectifying currents participate in control of bursting behavior in mesencephalic trigeminal neurons. Oral Science in Japan 2016: 13-16.
- Bakhshishayan S, Enomoto A, Tsuji T, Tanaka S, Yamanishi T, Ishihama K, Kogo M. Protein kinase A regulates the long-term potentiation of intrinsic excitability in neonatal trigeminal motoneurons. Brain Res. 2013 Dec 6;1541:1-8. doi: 10.1016/j.brainres.2013.10.010. Epub 2013 Oct 11.
- Okamoto R, Enomoto A, Koizumi H, Tanaka S, Ishihama K, Kogo M. Long-term potentiation of intrinsic excitability in trigeminal motoneurons. Brain Res. 2010 Feb 2;1312:32-40. doi: 10.1016/j.brainres.2009.11.039. Epub 2009 Nov 26.
2. 視床下部由来神経ペプチドによる摂食運動制御機構の解明
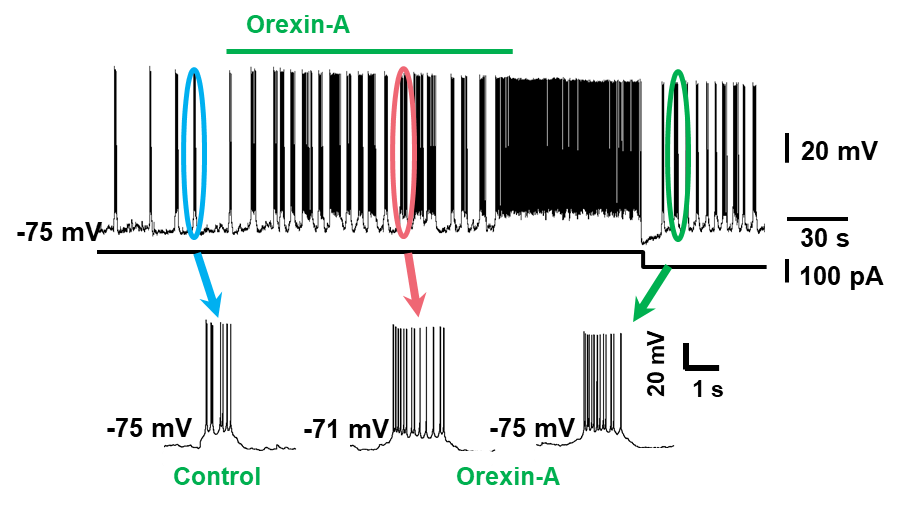
摂食機能は、上位中枢である視床下部腹内側核と外側野に存在する2つの中枢(満腹中枢と摂食中枢)により調節されており、分泌される様々な生理活性ペプチドがその役割を担っています。当教室では、摂食機能発現に関連が指摘されているニューロペプチドY (NPY)やオレキシン(orexin)に着目して、脳室内投与時に誘発される摂食運動特性について行動生理学的ならびに筋電図学的解析を用いて明らかにしてきました。これらの神経ペプチドが下位脳幹、特に三叉神経系ニューロンに対して如何なる作用を及ぼすかはこれまで不明でしたが、patch-clamp recordingによる最近のin vitro研究によって、NPY, orexinが運動ニューロン、中脳路核ニューロンに直接作用して、持続性Na+電流(persistent sodium current)を修飾することにより、ニューロンを興奮性に調節していることが明らかとされています。
関連論文
- Tanaka S, Higuchi M, Seki S, Enomoto A, Kogo M. Orexins modulate membrane excitability in rat trigeminal motoneurons. J Oral Sci. 2020 Jun 23;62(3):265-270. doi: 10.2334/josnusd.19-0141. Epub 2020 Jun 4.
- Seki S, Tanaka S, Yamada S, Tsuji T, Enomoto A, Ono Y, Chandler SH, Kogo M. Neuropeptide Y modulates membrane excitability in neonatal rat mesencephalic V neurons. J Neurosci Res. 2020 May;98(5):921-935. doi: 10.1002/jnr.24583. Epub 2020 Jan 19.
- Tsuji T, Tanaka S, Bakhshishayan S, Kogo M, Yamamoto T. Olfactory stimulation modulates the blood glucose level in rats. Int J Med Sci. 2018 Jan 18;15(3):269-273. doi: 10.7150/ijms.21528. eCollection 2018.
- Ushimura A, Tsuji T, Tanaka S, Kogo M, Yamamoto T. Neuropeptide-Y modulates eating patterns and masticatory muscle activity in rats. Behav Brain Res. 2015 Feb 1;278:520-6. doi: 10.1016/j.bbr.2014.10.031. Epub 2014 Nov 4.
- Tsuji T, Tanaka S, Kida K, Bakhshishayan S, Kogo M, Yamamoto T. Disrupted normal ingestion during glucose intake modulates glucose kinetics in humans. Springerplus. 2015 Oct 17;4:621. doi: 10.1186/s40064-015-1419-3. eCollection 2015.
- Tsuji T, Yamamoto T, Tanaka S, Bakhshishayan S, Kogo M. Analyses of the facilitatory effect of orexin on eating and masticatory muscle activity in rats. J Neurophysiol. 2011 Dec;106(6):3129-35. doi: 10.1152/jn.01108.2010. Epub 2011 Sep 21.
3. 機能性ペプチド(SVペプチド)を用いた骨格筋筋機能再生治療法の確立
骨格筋はもともと自己修復能を有していますが、大きな侵襲が加わると十分な筋再生が得られず、重度の機能障害をきたすことが知られています。オステオポンチン由来のSVVYGLRペプチドは、骨格筋損傷動物モデル、骨格筋前駆細胞を用いた基礎研究において、1) 損傷骨格筋において瘢痕形成を抑制し、筋組織の再生修復を促進して筋機能を優位に回復させることや、2) 転写調節因子の発現増強を伴い、骨格筋前駆細胞の遊走能、筋管細胞への分化誘導を促進することが明らかとなっています。本ペプチドは低分子量で既知の報告物質と比較して抗原性が低く、安全性が高いことや、組織の再生修復に不可欠な血管新生能を有していることに加えて、骨格筋由来細胞の活性上昇による筋線維再生促進と線維化形成抑制という異なる複数の機序に対して有効性を示す点において新規性があり、新しい筋組織再生修復治療剤として期待されます。また、皮膚や粘膜の創傷治癒過程を促進する作用も明らかとなっており、顎顔面領域を含む手術、外傷に対して広く適用できる可能性が示唆されており、社会実装に向けて医学研究科と共同で研究、開発を継続しています。
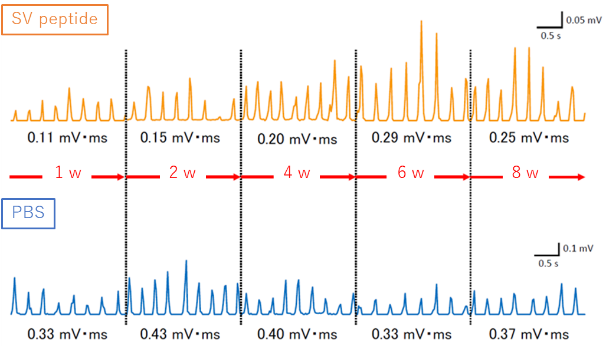
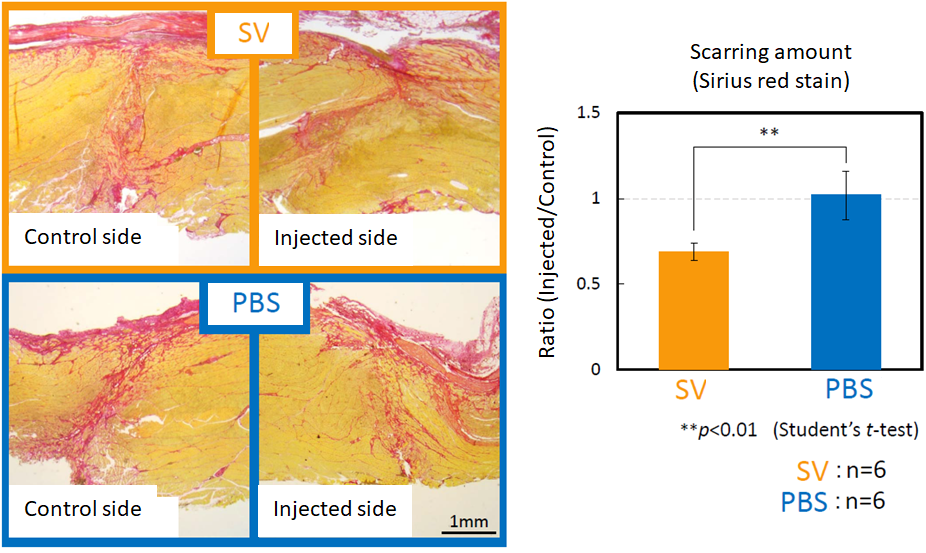
関連論文
- Tanaka S, Fujishita Y, Kawaguchi N, Usuki T, Yokoyama Y, Wu X, Mori S, Yamamoto H, Kogo M. The synthetic peptide SVVYGLR promotes cell motility of myogenic cells and facilitates differentiation in skeletal muscle regeneration. Dental Materials J. 2020 (in press).
- Tanaka S, Yasuda T, Hamada Y, Kawaguchi N, Fujishita Y, Mori S, Yokoyama Y, Yamamoto H, Kogo M. Synthetic peptide SVVYGLR upregulates cell 2motility and facilitates oral mucosal wound healing. Peptides. 2020 Dec; 170405. https://doi.org/10.1016/j.peptides.2020.170405
- Tanaka S, Matsushita Y, Hamada Y, Kawaguchi N, Usuki T, Yokoyama Y, Tsuji T, Yamamoto H, Kogo M. Osteopontin-derived synthetic peptide SVVYGLR has potent utility in the functional regeneration of oral and maxillofacial skeletal muscles. Peptides. 2019 Jun; 116:8-15. doi: 10.1016/j.peptides.2019.04.013. Epub 2019 Apr 17.
特許 PCT/JP2018/022329「骨格筋の損傷修復促進剤」
4. 電気生理学的手法を中心とした味覚システムに関する研究
味覚研究は古くから多くの研究者により多岐分野で行われており、その末梢・中枢レベルでの解析が飛躍的に進んではいるものの、多くのことが未だに解明されていない興味深い分野です。近年、新しい抗がん剤の研究開発により、多くの新薬が使用されるようになっていますが、それらの中には味覚障害を必発する薬剤も存在し、今後は味覚に関する更なる解明が重要になると考えられます。味覚は、一般に良く知られている5基本味(甘味・塩味・酸味・苦味・うま味)だけではなく、辛味や渋味、匂いや食感、そして記憶などが複雑に絡み合った複合感覚となっています。私たちは電気生理学的手法を中心に、組織学や行動学、嗅覚や一般体性感覚との関連など、様々な観点から味覚システムの解明を行っています。
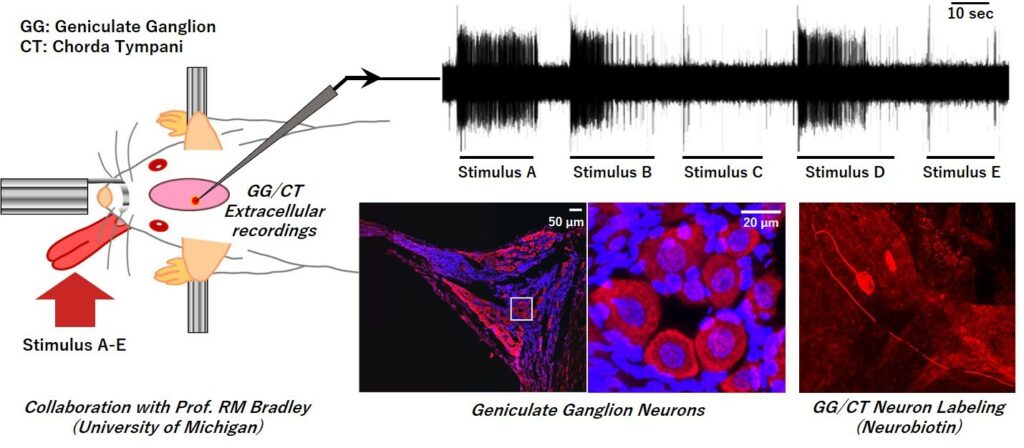
関連論文
- Kumari A, Yokota Y, Li L, Bradley RM, Mistretta CM. (2018 Nov): Species Generalization and Differences in Hedgehog Pathway Regulation of Fungiform and Circumvallate Papilla Taste Function and Somatosensation Demonstrated with Sonidegib. Scientific Reports. 8(1):16150. doi: 10.1038/s41598-018-34399-3
- Yokota Y and Bradley RM. (2017 Dec): Geniculate Ganglion Neurons are Multimodal and Variable in Receptive Field Characteristics. Neuroscience. 367:147-158. doi: 10.1016/j.neuroscience.2017.10.032.
- Yokota Y and Bradley RM. (2016 Jun): Receptive Field Size, Chemical and Thermal Responses, and Fiber Conduction Velocity of Rat Chorda Tympani Geniculate Ganglion Neurons. Journal of Neurophysiology. 115(6): 3062-3072. doi: 10.1152/jn.00045.2016.
- 山本 隆, 横田祐介. 味覚障害. In:口腔外科学 第4版 (白砂兼光, 古郷幹彦編). 医歯薬出版, 2020: 780-785. ISBN978-4-263-45843-3.
- POLAK YOUNG INVESTIGATOR AWARD. Yusuke Yokota. (2017 Apr): Somatosensory Characteristics of Receptive Fields of Rat Chorda Tympani Nerve/Geniculate Ganglion Soma. The 39th Annual Meeting of AChemS. 2017 Apr, Florida.
5. 口腔腫瘍が顎骨内で拡大するメカニズムの解析
口の中にできる良性腫瘍(歯原性腫瘍)や悪性腫瘍(口腔がん)には顎の骨を壊しながら大きくなります。私たちは、患者さんから頂いた細胞や実験動物を使って、腫瘍によって骨が壊れるメカニズムを明らかにしようとしています。腫瘍による骨の破壊は、腫瘍細胞が直接行うのではなく、破骨細胞とよばれる免疫系の細胞の活性化によっておきます。私たちは良性腫瘍である歯原性腫瘍の一部ではIL-1やTGF-βといったサイトカインを分泌し、それによって破骨細胞が活性化する可能性を見つけました(図1)。そして現在、私たちは悪性腫瘍である口腔がんと破骨細胞との関係に注目し、口腔がんによる顎の骨の破壊にはどうして様々な種類があるのかを解き明かす研究を行っています(図2)。
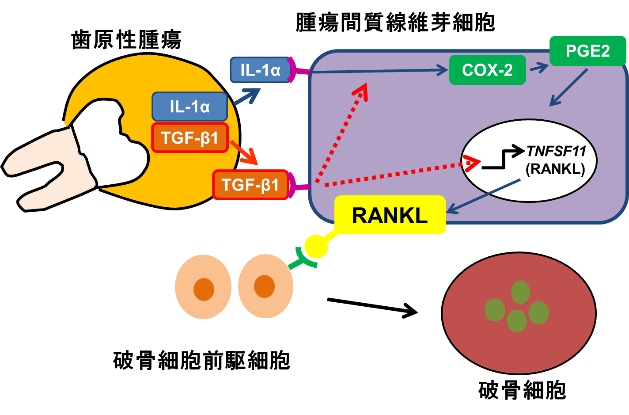
図1:歯原性腫瘍の顎骨内での増大は腫瘍から分泌されるサイトカインによって破骨細胞が誘導される
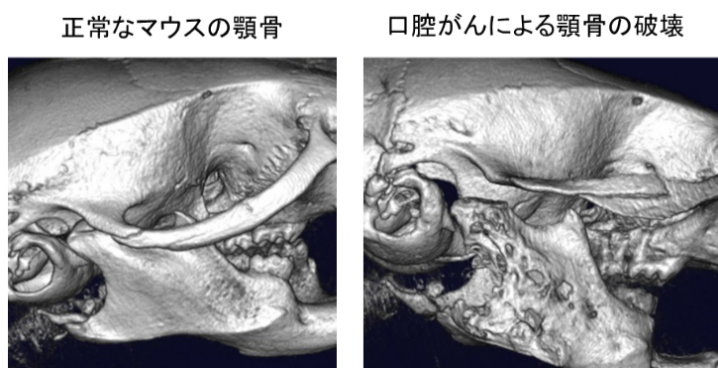
図2:口腔癌の細胞をマウスの顎骨に播種すると腫瘍の増大とともに顎骨が破壊される
関連論文
- Miyagawa K, Ohata Y, Delgado-Calle J, Teramachi J, Zhou H, Dempster DD, Subler MA, Windle JJ, Chirgwin JM, Roodman GD, Kurihara N. Oteoclast-derived IGF1 is required for pagetic lesion formation in vivo. JCI Insight. 2020 Mar; 5(6): e133113. DOI: 10.1172/jci.insight.133113
- Murata Y, Kurosaka H, Ohata Y, Aikawa T, Takahata S, Fujii K, Miyashita T, Morita C, Inubushi T, Kubota T, Sakai N, Ozono K, Kogo M, Yamashiro T. A novel PTCH1 mutation in basal cell nevus syndrome with rare craniofacial features. Human Genome Variation. 2019 April; 6(16): DOI: 10.1038/s41439-019-0047-9.
- Yamada C, Aikawa T, Okuno E, Miyagawa K, Amano K, Takahata S, Kimata M, Okura M, Iida S, Kogo M. TGF-β in jaw tumor fluids induces RANKL expression in stromal fibroblasts. International Journal of Oncology, 2016 Aug;49(2):499-508. DOI: 10.3892/ijo.2016.3548.
6. 頭蓋および顎顔面の硬組織に焦点を当てた発生学的研究
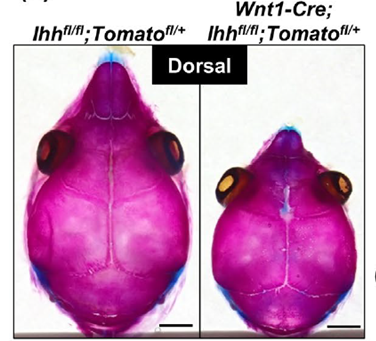
脊椎動物の骨格は骨芽細胞から形成される膜性骨化および軟骨細胞から骨化が進む内軟骨性骨化という2種類のプロセスにより発生します。近年の分子生物学的研究や遺伝子組み換えマウスを用いたin vivo研究の進歩により骨格形成に重要な因子や機序の解明が進んでいます。その一方で、頭蓋および顎顔面の硬組織は非常にユニークで複雑な形態を有する骨片の集合体と思われ、遺伝子研究を通してその形成に理解を深めることは歯科口腔外科領域では重要であると考えられます。そこで私たちは様々な因子の中からIndian Hedgehogと副甲状腺ホルモン受容体のシグナルに焦点を当てて頭蓋および顎顔面領域における機能および関連する分子機序の解明を行っています。
関連論文
- Amano K, Okuzaki D, Aikawa T, Kogo M (2020) Indian Hedgehog in Craniofacial Neural Crest Cells Links to Skeletal Malocclusion by Regulating Associated Cartilage Formation and Gene Expression. FASEB J. 2020 May;34(5):6791-6807.doi: 10.1096/fj.201903269R. Epub 2020 Mar 29.
- Amano K, Densmore MJ, Fan Y, Lanske B. (2016 Feb): Ihh and PTH1R signaling in limb mesenchyme is required for proper segmentation and subsequent formation and growth of digit bones. Bone.;83:256-66. doi: 10.1016/j.bone.2015.11.017. Epub 2015 Nov 24.
- Amano K, Densmore MJ, Lanske B. (2015 Dec): Conditional Deletion of Indian Hedgehog in Limb Mesenchyme Results in Complete Loss of Growth Plate Formation But Allows Mature Osteoblast Differentiation. J Bone Miner Res.;30(12):2262-72. doi: 10.1002/jbmr.2582. Epub 2015 Jul 29.
- Amano K, Densmore M, Nishimura R, Lanske B. (2014 Sep 5): Indian hedgehog signaling regulates transcription and expression of collagen type X via Runx2/Smads interactions. J Biol Chem. 289(36):24898-910. doi: 10.1074/jbc.M114.570507. Epub 2014 Jul 15.
7. 口腔癌浸潤転移のメカニズムの解明と新規治療法開発に向けた研究
口腔癌は、全悪性腫瘍の1-2%、頭頚部癌の約40%を占め、日本で年間約8000人が罹患される疾患です。また、喫煙・飲酒を嗜好する国では口腔癌罹患数はさらに高く、食事や生活習慣の欧米化が進む日本でも増加傾向にあります。口腔癌は、手術を中心に、放射線、化学療法を併用し治療されますが、進行、再発症例に対しては必ずしも充分ではなく、また顔貌などの審美的低下や食事や会話に大きな支障が出ることから、低侵襲で治療効果の高い新たな治療法が必要とされており、下記のような研究を行っております。
1)口腔癌治療の実臨床に即したマウスモデルの作成
口腔癌の浸潤・転移のメカニズムの解明や新規治療法の効果や安全性の検討のためには実際の臨床に類似したマウスモデルの作成が必須であり、下記のような様々な口腔癌モデルを作成しています。一方、癌の微小環境の中では、癌を組織作る間質、ヒアルロン酸などが癌の増殖や免疫などに深く関わっていることが知られています。その中で、乳癌の浸潤にも大きく関わると言われている新規ヒアルロン酸分解:TMEM2をノックアウトしたマウスを本学矯正科と共同で作成し、口腔癌の治療標的遺伝子となり得るか、マウスモデルを作成して検討しています。
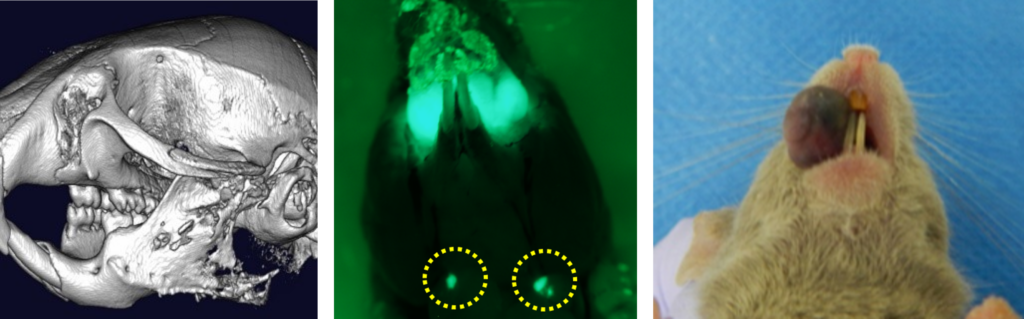
左から顎骨浸潤モデル、舌癌頸部リンパ節転移モデル(GFP)、口腔悪性黒色腫モデル
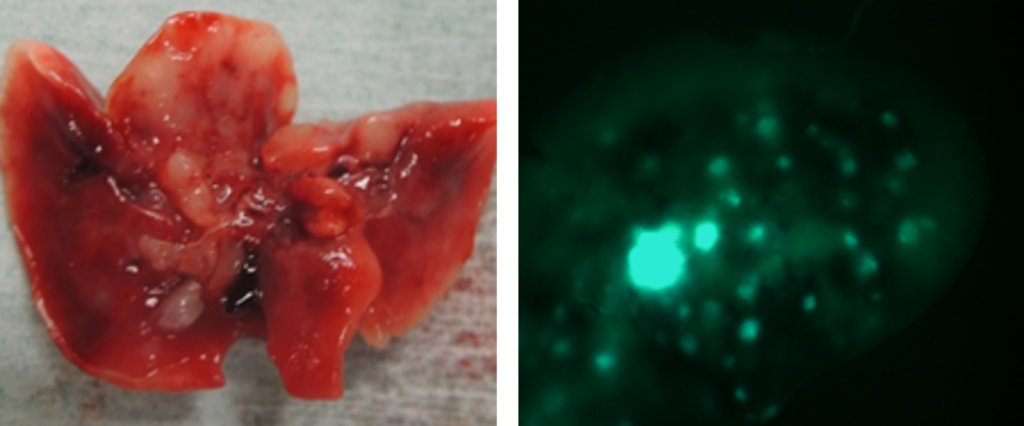
肺転移モデル
関連論文
- Yabuno Y, Uchihashi T, Sasakura T, Shimizu H, Naito Y, Fukushima K, Ota K, Kogo M, Nojima H, Yabuta N.Clathrin heavy chain phosphorylated at T606 plays a role in proper cell division. Cell Cycle. 2019.8;18(16),1976-1994.
- UchihashiT, Ota K, Yabuno Y, Ohno S, Fukushima K, Naito Y, Kogo M, Yabuta N, Nojima H. ELAS1 induces apoptotic death in adenocarcinoma DU145 and squamous-cell carcinoma SAS cancer cells, but not in normal KD cells. Oncotarget. 2017 Aug 24;8(49):85868-85882.
- Fujibayashi E, Yabuta N, Nishikawa Y, Uchihashi T, Miura D, Kurioka K, Tanaka S, Kogo M, Nojima H. Isolation of cancer cells with augmented spheroidforming capability using a novel tool equipped with removable filter. Oncotarget. 2018; 9:33931-33946.
- Ohno S, Ikeda JI, Naito Y, Okuzaki D, Sasakura T, Fukushima K, Nishikawa Y, Ota K, Kato Y, Wang M, Torigata K, Kasama T, Uchihashi T, Miura D, Yabuta N, Morii E, Nojima H. Comprehensive phenotypic analysis of knockout mice deficient in cyclin G1 and cyclin G2. Sci Rep. 2016 Dec 16;6:39091.
2)第三世代がん治療用単純ヘルペスウイルスI型を用いた口腔癌の新規治療法の開発
東京大学医科学研究所先端がん治療分野・藤堂らが開発した新規がん治療用ウイルスであるG47Δは悪性脳腫瘍などで臨床試験が進んでおり、実用化が迫っています。当グループは東京大学と共同で、この三重変異を有するがん治療用ヘルペスウイルスI型と類似の基本骨格をもったウイルスを用いた新規口腔癌治療の開発を行っています。培養細胞に対して著しい抗癌作用を持つだけでなく、1)であげたマウスモデルを用いたこれまでの研究結果で、この治療法では前臨床試験において極めて高い安全性を示し、口腔がん治療において重要なリンパ節転移にも有効な治療効果が示唆されていると同時に、審美面の保持、咀嚼嚥下、構音などの口腔の重要な機能の温存が期待されています。最近では、IL-12などの免疫賦活化遺伝子を発現するウイルスを用いたさらなる治療効果の増強を図る研究や、近年臨床現場で癌治療の現場で盛んに用いられるようになったオブジーボとの併用実験を行うなど、現状の治療法に加えて新たな口腔癌治療法として応用できるように研究を進めています。
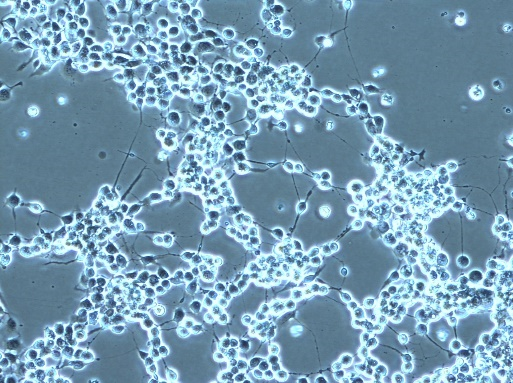
口腔癌細胞ががん治療用ウイルスに感染し、死滅している様子
関連論文・著書
- がんと免疫「がんのウイルス療法」: 内橋俊大 藤堂具紀, 南山堂 第19 章 168-173, 2015 坂口志文、西川博嘉編
- Uchihashi T, Nakahara H, Fukuhara H, Iwai M, Ito H, Sugauchi A, Tanaka M, Kogo M, Todo T. Oncolytic herpes virus G47Δ injected into tongue cancer swiftly traffics in lymphatics and suppresses metastasis. Mol Ther Oncolytics. 2021 Jun 24;22:388-398.
